각운동량의 양자화
우리는 3차원 공간 속 원자의 상태를 결정짓는 양자수가 3개가 있음을 안다. 이를 각각 기호 \(n,l,m\)으로 나타내며 주양자수, 부양자수, 자기양자수라 부른다. 이때 주양자수는 핵으로부터의 거리를 의미한다는 것이 명확하게 받아들여지는 반면 부양자수, 자기양자수의 의미는 쉽게 받아들이기 힘들다. 부양자수는 '각운동량 양자수'라고도 불리며, 이는 각운동량이 양자화되어있다는 의미이다. 그런데 '왜 각운동량이 양자화되어있나'는 직관적으로 받아들여지지가 않는다. 이 글에서는 각운동량 양자화의 의미를 소개하고자 한다.
보어의 각운동량 양자화 가설
보어는 그의 원자 모형을 개발하면서 원자 궤도를 안정화시키기 위해 각운동량의 양자화를 가정한다. 기존 러더퍼드의 원자 모형에서의 문제점은 궤도의 안정성이 보장되지 않는다는 점이었다. 아래 그림과 같이, 러더퍼드 모형에서는 핵 주위를 도는 전자는 운동하다가 빛을 방출하면서 나선형 궤도를 그리며 핵으로 떨어지게 된다.
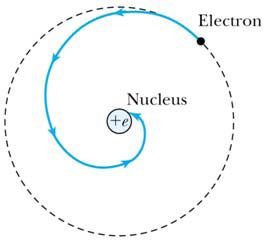
보어는 이를 수정해야 했다. 보어의 원자모형에서는 전자가 핵 주위를 반지름이 일정한 원 궤도로 돈다고 보았다. 자신의 모형을 설명하기 위해, 보어는 세 가지 조건을 가정하였다. 그가 세운 첫 번째 가정은 전자가 존재할 수 있는 궤도는 불연속적이라는 것이었고, 두 번째 가정은 두 궤도 사이에서 전자는 궤도 간 에너지 간격에 해당하는 광자를 방출 또는 흡수하면서 전이한다는 것이었다. 이를 바탕으로 한 보어 모형은 후에 드 브로이의 물질파 개념을 통해 특정 양자조건을 만족시키는 궤도만 안정적으로 존재할 수 있으며 이러한 궤도들이 불연속적으로 존재한다는 설명으로 이어졌다. 이를 통해 에너지의 양자화를 설명할 수 있었으며, 러더퍼드 모형의 문제점처럼 전자가 '나선형' 구조를 그리며 핵으로 '다가가는' 현상은 배제할 수 있었다.
그러나 보어가 처음 이 모형을 발표할 당시에는 물질파 개념이 정립되기 전이었다. 그래서 그는 드 브로이의 물질파 개념 없이도 그의 모델에서 궤도의 안정성을 설명할 수 있어야 했다. 이 때문에 도입한 가정이 세 번째 가정인 각운동량 양자화 가정이다. 그는 다음과 같이 각운동량이 양자화되어있다고 가정하였다.
\[L=n\dfrac{h}{2\pi}=n\hbar \quad \left( n=1, 2, 3, \cdots \right)\]
이 가정과, 핵과 전자 사이의 쿨롱 힘이 원심력과 같은 크기를 갖는다는 점에서
\[r=\dfrac{\epsilon_0^2n^2h^2}{\pi e^2m_e}\]
와 같이 궤도의 반지름이 불연속적이라는 것을 설명할 수 있었다. 결국은 각운동량의 양자화 역시 에너지의 양자화와 함께 설명될 수 있는 것이다.
좀머펠트의 반론
보어는 원자구조에 대한 좋은 설명을 한 것 처럼 보였지만, 상당히 많은 근사가 있었다. 그 중 하나가 전자가 핵 주위를 원운동한다는 것이었는데, 독일의 물리학자 좀머펠트가 이에 반론을 제기하였다. 그는 양자는 원운동만을 하지 않는다는 것을 보였다. 결국은 \(L=n\hbar\)라는 가정도 적합하지 않다는 것이었다. 따라서 이후에, 하이젠베르크, 드 브로이, 슈뢰딩거 등의 연구가 진행되면서 각운동량 양자화에 대한 다른 설명이 나오게 된다. 우리는 슈뢰딩거의 파동방정식의 해석을 통해 이를 알아볼 수 있다.
슈뢰딩거 파동방정식
먼저 수소 원자에 대한 슈뢰딩거 파동방정식은 다음과 같다.
\[\tag{1} -\dfrac{\hbar}{2m}\nabla^2\psi + V(r)\psi = E\,\psi\]
이때 우리는 이 방정식을 편한 이해를 위해 구면좌표계에서 생각하고자 한다. 구면좌표계에서의 라플라스 연산자는 다음과 같이 기술된다.
\[\tag{2} \nabla^2 = \dfrac{1}{r^2}\dfrac{\partial}{\partial r} \left( r^2\dfrac{\partial}{\partial r}\right) + \dfrac{1}{r^2\sin\theta}\dfrac{\partial}{\partial\theta} \left( \sin\theta\dfrac{\partial}{\partial\theta} \right) + \dfrac{1}{r^2\sin^2\theta}\dfrac{\partial^2}{\partial\phi^2}\]
또한 파동함수가 \(r, \theta, \phi\) 각각에 대하여 변수분리가 가능하다고 가정하고 각각에 대한 함수의 곱으로 나타낼 수 있다. 파동함수 \(\psi\)를 변수분리하여 다음과 같이 나타내보자.
\[\tag{3} \psi(r,\theta,\phi) = R(r)\Theta(\theta)\Phi(\phi)\]
(2), (3)를 (1)에 대입하면
\[\scriptsize -\dfrac{\hbar^2}{2m}\left\{ \dfrac{1}{r^2}\dfrac{\partial}{\partial r} \left( r^2\dfrac{\partial R}{\partial r}\Theta\Phi \right)+\dfrac{1}{r^2\sin\theta}\dfrac{\partial}{\partial\theta} \left( \sin\theta\dfrac{\partial\Theta}{\partial\theta}\Phi R \right) + \dfrac{1}{r^2\sin^2\theta}\dfrac{\partial^2\Phi}{\partial\phi^2}R\Theta \right\} + V(r)\psi = E\,\psi\]
이 나오고, 이때 \(R, \Theta, \Phi\)는 각각 \(r, \theta, \phi\)에 관한 함수이므로 편미분을 전미분으로 바꾸어 나타낼 수 있다. 또한 양변을 \(\dfrac{\hbar^2R\Theta\Phi}{2m}\)으로 나누어 정리하면
\[\tag{4} \scriptsize \dfrac{\sin^2\theta}{R}\dfrac{d}{dr}\left(r^2\dfrac{dR}{dr}\right) + \dfrac{\sin\theta}{\Theta}\dfrac{d}{d\theta}\left(\sin\theta\dfrac{d\Theta}{d\theta}\right) + \dfrac{2m}{\hbar^2}r^2\sin^2\theta\left(E-V(r)\right) = -\dfrac{1}{\Phi}\dfrac{d^2\Phi}{d\phi^2}\]
와 같이 정리된다. (4)에서 좌변은 \(r,\theta\)에 관한 함수, 우변은 \(\phi\)에 관한 함수인데, 파동방정식에서 각각은 모두 독립변수이므로 등호가 성립하기 위해서는 좌변과 우변이 각각 변수와 무관한 상수여야 한다. 따라서 우변을
\[-\dfrac{1}{\Phi}\dfrac{d^2\Phi}{d\phi^2} = {m_l}^2\]
이라 하자. \(m_l\)은 추후에 결국 자기양자수가 된다. 다시 좌변을 정리하여 \(r\)과 \(\theta\)에 대한 식으로 분리해보자.
\[\dfrac{1}{R}\dfrac{d}{dr}\left(r^2\dfrac{dR}{dr}\right) + \dfrac{2mr^2}{\hbar^2}\left(E-V(r)\right) = \dfrac{{m_l}^2}{\sin^2\theta} - \dfrac{1}{\Theta\sin\theta}\dfrac{d}{d\theta}\left(\sin\theta\dfrac{d\Theta}{d\theta}\right)\]
여기서도 좌변은 \(r\)에 관한 함수, 우변은 \(\phi\)에 관한 함수이므로 당연히 양변은 상수여야 한다. 이때 이 상수 값을 \(l(l+1)\)이라 두자. 좌변에 대한 식만 정리하면, 다음과 같이 쓸 수 있다.
\[\tag{5} \dfrac{1}{r^2}\dfrac{d}{dr}\left(r^2\dfrac{dR}{dr}\right) + \dfrac{2m}{\hbar^2}\left[E - V(r) - \dfrac{\hbar^2l(l+1)}{2mr^2} \right]R = 0\]
여기서 \(l\)은 각운동량이 양자화되어있다는 가정 아래에서 정수이다(0 포함). 이 식은 각운동량이 양자화되어있다는 가정 아래에서 세워진 것이고, 이후에 \(l\)이 각운동량과 관련되어있음을 보여 \(l\)의 불연속성이 각운동량의 불연속성(양자화)으로 이어진다는 것을 설명할 것이라고 이해하면 된다.
중심력과 유효 퍼텐셜
수소 원자에 대한 이야기를 할 때, 전자는 1개밖에 없기 때문에 전자가 받는 힘은 핵으로부터 받는 전자기력 뿐이다. 전자는 중심력을 받고 핵 주위를 돌고 있는 것으로 생각한다면, 우리는 고전역학에서의 중심력과 회전운동에 대한 해석을 가지고 올 수 있다.
중심력을 받고 있는 계에서 각운동량은 보존되므로, 운동 과정에서 각운동량 \(L\)의 값은 언제나 일정하다. 따라서 우리는 3차원을 다루고 있지만, 이 문제는 대칭성을 가져 평면 위에서 생각해도 된다.
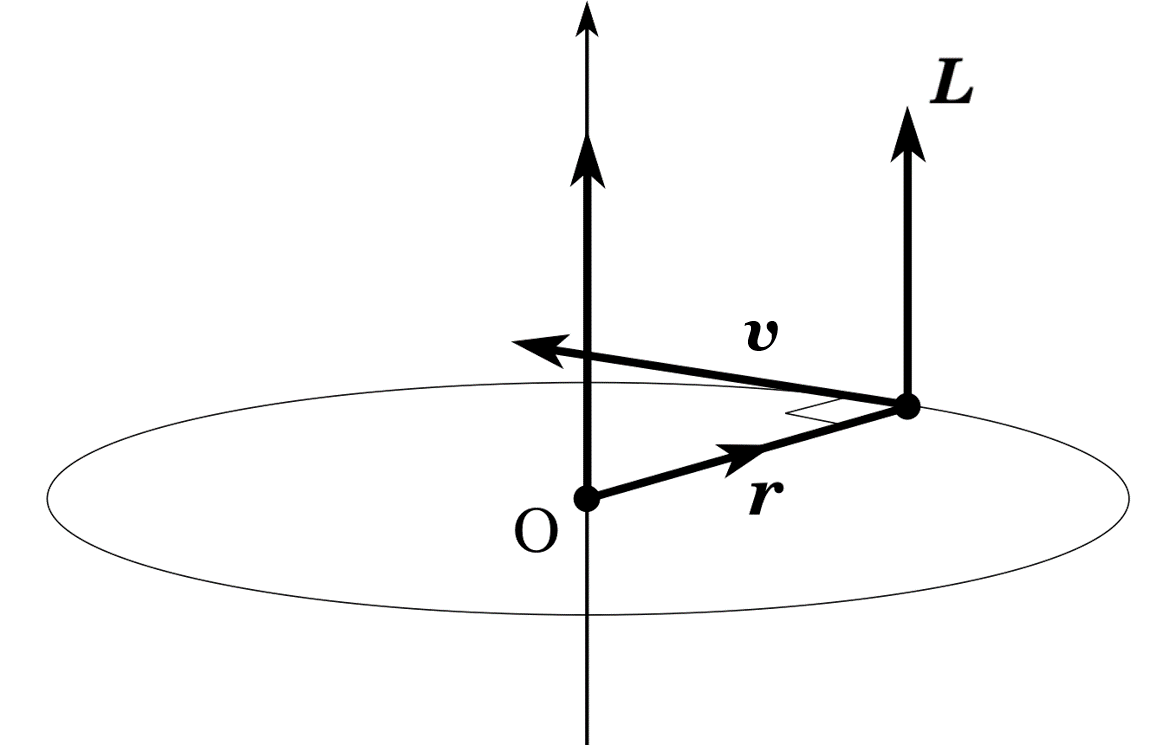
이때 원점을 중심으로 회전하는 계의 에너지는 다음과 같다.
\[\dfrac{1}{2}m\left( \dot{r}^2+r^2\dot{\theta}^2 \right)+V(r)=E\]
\(\dfrac{1}{2}m\dot{r}^2\)은 지름방향의 운동에너지, \(\dfrac{1}{2}mr^2\dot{\theta}^2\)은 각방향의 운동에너지, \(V(r)\)이 퍼텐셜에너지이다. 운동에너지 항이 두 개나 존재하는 이유는 운동궤도 때문이다. 원운동을 하고 있다면, 즉 \(r\)이 일정하여 \(\dot{r}=0\)이면 지름방향의 운동에너지는 존재하지 않는다. 그러나 타원운동과 같이 \(r\)이 변하는 운동을 하면 전체 에너지에 지름방향의 운동에너지도 추가되는 것이다. 이때 움직이는 계 위에서 생각한다면, 실질적인 퍼텐셜에너지는 각방향 운동에너지와 외부에서 바라본 퍼텐셜에너지의 합으로 느껴진다. 이를 유효 퍼텐셜에너지라 한다.
\[\tag{6}V_{eff}(r) = \dfrac{1}{2}mr^2\dot{\theta}^2 + V(r)\]
이제 다시 (5)로 돌아가 각 항의 의미를 생각해보자. 파동방정식을 정리한 식인 (5)에서, 첫번째 항은 파동방정식의 \(R(r)\)함수에서 나온 항이고, 두번째 항은 전체 에너지와 퍼텐셜에너지로부터 나온 항이다. \(\left[\;\right]\)로 묶인 부분이 전체 에너지와 퍼텐셜에너지의 차와 관련된 항으로 보인다. 특히 \(l\)을 포함하는 부분은 \(l\)이 \(\theta\), \(\phi\)와 관련되어있기 때문에 각도와 관련있는 에너지항인 것으로 보인다. 따라서 (6)과 (5)를 비교하면, \(V(r) + \dfrac{\hbar^2l(l+1)}{2mr^2}\)이 유효퍼텐셜을 의미해야 함을 알 수 있고, 다음과 같이 유효퍼텐셜에 추가된 항끼리 대응됨을 파악할 수 있다.
\[\dfrac{1}{2}mr^2\dot{\theta}^2 = \dfrac{\hbar^2l(l+1)}{2mr^2}\]
이때 각방향 운동에너지는 각운동량(\(L=mrv\))을 포함하여 \(\dfrac{1}{2}mr^2\dot{\theta}^2 = \dfrac{L^2}{2mr^2}\)와 같이 표현이 가능하므로,
\[L^2 = l(l+1)\hbar^2\]
\[L = \sqrt{l(l+1)}\hbar \quad \left( l=0, 1, 2, \cdots \right)\]
를 구할 수 있다. 당연하게도, \(l\)이 각운동량 양자수이고 이로 인해 각운동량은 양자화되어있음이 드러난다.
이는 보어가 가정한 것과는 다른 형태이다. 보어의 가정에서 '\(n\)'자리에 \(\sqrt{l(l+1)}\)이 들어간 것이다. 그러나 결론적으로는 각운동량의 양자화가 에너지의 양자화, 원자궤도의 불연속 등과 같은 뿌리에서 설명이 된다는 점에서는 양자역학에서 모두 비슷한 의미로 받아들일 수 있음을 느낄 수 있다.
참고로 자기양자수 \(m_l\)은 각운동량의 \(z\)성분을 양자화시키며 다음과 같은 관계가 성립한다.
\[L_z = m_l \hbar\]
결론
물론, 이 방법은 엄밀한 방법은 절대 아니다. 우선 양자역학의 영역에 고전역학을 사용하였고, 파동방정식과 유효퍼텐셜 식 간의 비교도 정확해보이지는 않는다. 엄밀한 설명을 위해서는 해밀토니안을 통해 슈뢰딩거 방정식을 기술하고 고전적인 각운동량이 아닌 '각운동량 연산자'를 정의하여 위 관계를 보여야 한다. 그러나 슈뢰딩거 방정식의 근사가 고전역학에 부합해야 한다는 점에서 양자역학을 처음 배우는 과정에서 각운동량 양자수의 의미를 이해하기에는 괜찮은 설명이다. 따라서 이를 통해 각운동량이 양자화되어있다는 점을 설명할 수 있다.
각운동량 양자화에 대한 더 정확한 설명이 궁금하면 다음 동영상을 보면 도움이 될 것이다. \(\scriptsize(\sout{많이\; 어렵다})\)
참고문헌
[1] Schroeder, Daniel. Notes on Quantum Mechanics. Weber State University, 2020.
[2] Oxtoby, David W, et al. Principles of Modern Chemistry. 7th ed., Cengage, 2012.
Cover Image from https://wallpapercave.com/wp/wp4010385.jpg
