신약 개발의 새로운 패러다임: 'PROTACs'
서론
사이언스(Science) 2017년 3월 17일 자 '암 치료 분야의 선구자들'이라는 제목의 특집을 필두로 하여 최근 신약 개발 플랫폼에 있어 ‘프로탁’(PROTACs: Proteolysis Targeting Chimeras)으로 불리는 표적 단백질 제거 기술이 큰 주목을 받고 있다.
PROTACs?
소분자화합물 치료제(small molecule drug)는 질병과 관련 있는 특정 단백질의 활성부위(active site)나 결합부위(binding pocket)에 결합함으로써, 문제의 단백질 활성을 억제하거나 그 단백질이 다른 단백질과 결합하기 어렵게 해 질병치료 효과를 기대한다. '프로탁'이라 불리는 소분자 약물은 '질병 관련 표적단백질'에 '단백질 분해 유도효소'를 가까이 붙여 특정 질병 단백질을 분해하는 새로운 약물 작용 원리이다.
일반적인 약물은 특정 단백질의 특정 부위에 결합함으로써 그 단백질의 기능을 저하시키는 방식으로 약효를 발현한다. 하지만 프로탁은 유비퀴틴-프로테아좀 경로(Ubiquitin proteasome system)를 이용하여 선택적으로 표적 단백질을 제거하는 방식으로 약효를 발현함으로써 기존의 약물 개발 기법으로는 공략하기 어려운 질병 유발 단백질의 80% 이상을 분해할 수 있으며 기존 약물의 내성 문제 역시 극복 가능하다. 본 기술을 이용하면 기존의 신약개발 방법으로는 접근할 수 없었던 치매, 암 등 난치성 질환 관련 단백질을 약물표적으로 이용할 수 있다.
PROTACs의 작용기작
프로탁의 작용기작을 알아보기 위해서는 먼저 인체의 단백질 분해 시스템인 유비퀴틴-프로테아좀 경로(Ubiquitin proteasome system)에 대한 이해가 필요하다.유비퀴틴-프로테아좀 경로는 표적이 되는 기질단백질에 76개의 아미노산으로 이루어진 유비퀴틴 단백질(ubiquitin)이 공유결합을 통해 표지되고 이를 단백질 분해 복합체인 26S 프로테아좀(proteasome)이 인지하여 분해하는 기작이다. 유비퀴틴-프로테아좀 경로는 다시 유비퀴틴화(Ubiquitination)와 프로테아좀 분해로 나뉜다.
>유비퀴틴화 프로테아좀 경로의 작용기작
- 유비퀴틴화(Ubiquitination)
유비퀴틴화(Ubiquitination)는 E1, E2, E3효소를 이용하여 유비퀴틴단백질을 활성화 시키고 표적 단백질로 운반하여 표적 단백질에 활성화된 유비퀴틴단백질을 결합시켜 표지하는 과정이다.
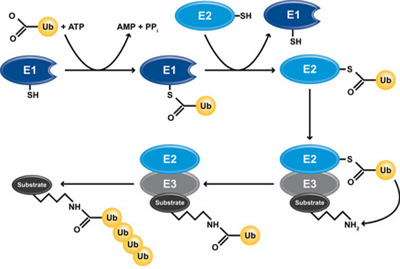
먼저 유비퀴틴화가 시작되기 위해서는 E1효소가 필요하다. 유비퀴틴단백질의 Hydroxyl group(-OH)과 E1 효소 꼬리부분의 시스테인 단백질의 Sulfhydryl group(-SH)이 ATP의 가수분해 에너지를 이용한 탈수 축합 반응을 통해 Thioester결합을 생성함으로서 E1 효소의 꼬리에 유비퀴틴이 부착되며 E1의 효소 작용을 통해 유비퀴틴의 활성화가 일어난다.
다음으로 활성화된 유비퀴틴을 E1효소에서 E2효소로 운반하는 과정이 필요하다. E1효소와 유비퀴틴 사이의 Thioester결합이 끊어지고 유비퀴틴은 E2효소로 이동하여 E2효소 꼬리부분의 시스테인 단백질의 Sulfhydryl group(-SH)과 새로운 Thioester결합을 생성함으로써 E2효소의 꼬리에 활성화된 유비퀴틴이 부착된다.
E3효소는 E2효소와 표적 단백질과 모두 반응하는 효소로 표적 단백질과 E2효소 사이로 들어가 E2효소와 표적 단백질에 동시에 결합한다. 결합이후에는 RING 단백질을 이용하여 E2효소로부터 유비퀴틴을 떼어내고 표적 단백질로 운반한 후 HECT 단백질을 통해 표적 단백질의 아미노산 중 라이신의 Amino group(-NH)과 유비퀴틴의 C-말단부에 존재하는 아미노산인 글라이신의 Carboxyl group(-COOH) 사이의 Isopeptide결합을 생성한다.
위 과정이 반복적으로 일어나면 표적 단백질에 유비퀴틴이 사슬형태로 결합되어 표지 역할을 한다. 이 과정을 통틀어 ‘유비퀴틴화‘ 라고 한다.
- 프로테아좀 분해
프로테아좀에 의한 분해는 유비퀴틴화를 통해 표지된 표적 단백질이 프로테아좀의 19S, 20S 두 서브유닛을 거쳐 아미노산으로 분해되는 과정이다.
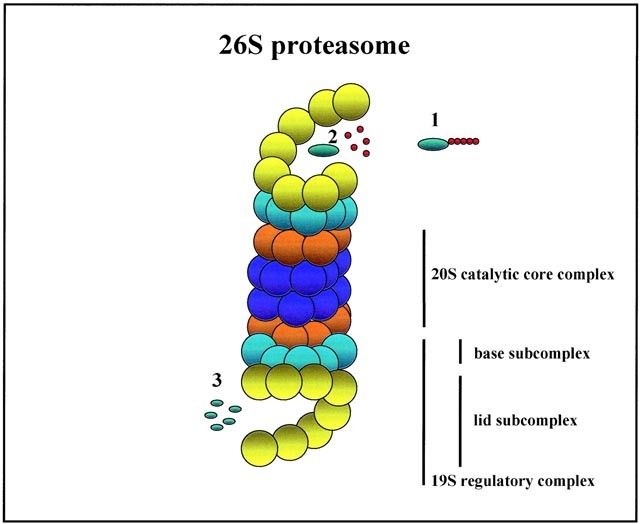
유비퀴틴화 된 표적 단백질은 프로테아좀으로 운반되고 프로테아좀의 19S 서브유닛은 유비퀴틴단백질(Ubiquitin)을 인식하여 표적단백질과 결합하고 ATP(Adenosine triphosphate) 인산기 가수분해 에너지를 이용하여 표적단백질의 입체 구조를 파괴하여 아미노산의 선형 결합 형태로 변환한다.
이후 20S 서브유닛에 의해 표적 단백질은 유비퀴틴으로부터 분리된 후 여러 조각의 펩타이드로 분해되고 Cellular proteases의 작용으로 아미노산 간의 펩타이드 결합이 모두 가수분해되어 표적 단백질이 아미노산 단위로 흩어진다.
>PROTACs의 작용기작
이러한 체내 단백질 분해 원리를 이용하여 질병에 관여하는 단백질을 선택적으로 분해하기 위한 기술이 바로 ‘PROTACs’이다. PROTACs (Proteolysis-targeting chimaera) 기술은 저분자화합물 기반 신약개발 플랫폼 기술로서 E3효소 리간드(결합모듈)-연결체-표적단백질 리간드(결합모듈)로 구성되어 E3와 표적단백질에 동시에 결합할 수 있는 이작용성 화합물을 이용하며, 질병 유발 표적단백질의 유비퀴틴화를 통해 생체 내 분해를 유도하는 기술이다.
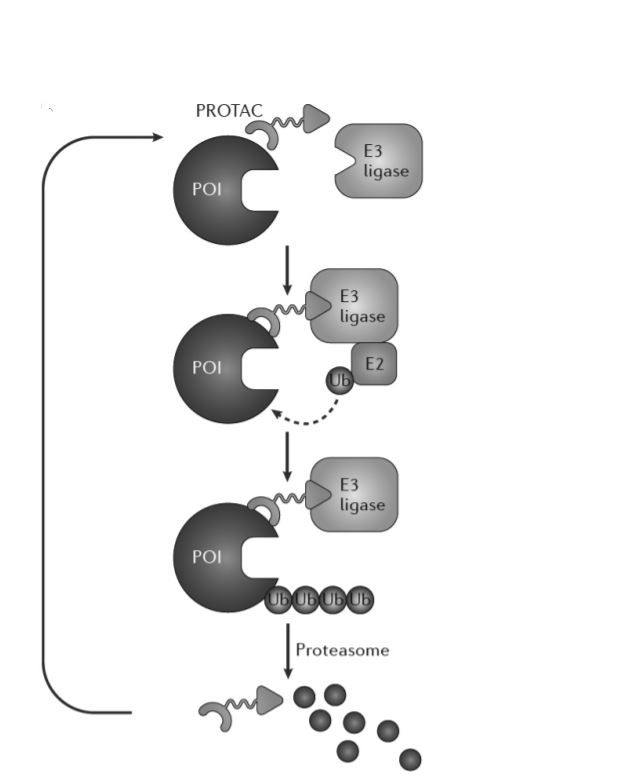
PROTACs 기술의 작용기전은 그림과 같이 결합, 유비퀴틴화, 분해, 재사용의 4단계로 구분된다. 먼저 표적 단백질과 E3효소 사이에 결합하는 PROTACs의 E3효소 리간드에는 E3효소가, 표적 단백질 리간드에는 표적 단백질이 결합되어 하나로 연결된 복합체를 형성한다.
복합체 형성 후 PROTACs의 매개로 E3효소가 표적 단백질에 작용하여 표적단백질을 유비퀴틴화 한다. 이후 유비퀴틴화 된 단백질은 PROTACs으로부터 분리되어 프로테아좀에 의해 분해되고 PROTACs은 동일한 방법으로 재활용된다.
PROTACs 기술의 핵심
이러한 PROTACs 기술의 핵심은 표적단백질을 유비퀴틴화 시킬 수 있는 E3효소와 표적 단백질을 리간드를 통해 정확히 매개하는 능력이기 때문에 표적단백질에 적합한 E3효소 리간드와 표적단백질 리간드의 발굴, 이작용성 화합물 디자인 및 합성기술이 요구된다.
초기의 PROTACs은 2002년 E3효소 리간드로 펩타이드를 합성하여 사용하였지만 낮은 세포 투과도와 미미한 효능을 보였고 약학적 효능을 인정받지 못했다. 이러한 한계점을 극복하기 위해 2014년 저분자(small molecule)를 합성한 E3효소 리간드를 개발하여 표적단백질 분해력을 높여 단백질 분해효과를 인정받았으며 이후 2015년을 기점으로 현재까지도 끊임 없는 리간드의 탐색과 최적화를 통해 그 작용 범위를 넓혀나가고 있다.
PROTACs 국내외 동향과 전망
PROTACs 기술은 미래유망 신약개발 플랫폼 기술로 국가를 막론하고 활발한 연구가 이루어지는 뜨거운 감자다. 하지만 아직까지 PROTACs기술은 연구된 역사가 짧고 대부분의 기업이 연구 개발 단계에 있는 초기단계 기술이다. 2015년에는 동물을 모델로 한 실험에서 효능을 인정 받았고, 같은 해 배양된 혈액암 세포에 대한 분해능력이 검증되었다. 현재 PROTACs 기술을 기반으로 신약개발은 주로 신생물질환, 퇴행성 뇌질환, 자가면역질환, 섬유화증 등 난치성질환의 치료에 집중하고 있으며 가장 개발이 진척된 Arvinas사의 ARV-378, ARV-110의 경우, 현재 임상실험이 진행중이며 최근까지는 긍정적인 실험 결과를 보이고 있다.
PROTAC 기술이 차세대 신약 개발 플랫폼으로 입지를 확보하기 위해서는 다양한 활용 가능한 E3효소 리간드의 탐색, 다양한 이작용성 화합물 디자인, 적용 가능한 표적단백질 검증, 안정성과 효율성 증대, 임상에서의 효능 및 독성 검증 등의 다양한 과제들이 남아있다. PROTACs 기술은 미국을 중심으로 연구개발 및 특허 출원이 활발하게 이루어지고 있는 것으로 분석되고, 한국의 경우 꾸준하게 특허출원이 진행되고 있으나, 특허건수가 미미하다.
다국적 제약사들은 차세대 신약개발 플랫폼 기술인 PROTACs에 대한 수요가 매우 크며, 본 기술을 성공적으로 구현 하게 된다면 기술 수출을 통해 막대한 기술료 수입 이 가능할 것으로 예측된다. 현재 국내 제약 산업계에서는 연구 기반의 미약으로 활발한 연구가 이루어지지 못하고 있는 실정이다. 따라서 우리나라는 본 기술을 확보하기 위하여 미국, 일본 등 제약기술 선진국에 대해 fast follower 전략을 구사하며 선진국과의 기술격차를 줄이기 위한 정부의 전폭적인 투자와 지원이 필요하다.
참고문헌
[1] 이상호, 박세진, 하재두, 황종연(2018), 차세대 신약개발 플랫폼: 표적 단백질 분해 기술, KEIT PD Issue Report, 18-3, 18-40.
[2] Pickart CM (2001). "Mechanisms underlying ubiquitination". Annual Review of Biochemistry. 70: 503–33.
[3] van Wijk SJ, Timmers HT (April 2010). "The family of ubiquitin-conjugating enzymes (E2s): deciding between life and death of proteins". FASEB Journal. 24 (4): 981–93.
[4] Skaar JR, Pagano M (December 2009). "Control of cell growth by the SCF and APC/C ubiquitin ligases". Current Opinion in Cell Biology. 21 (6): 816–24.
[5] “Protac: Chimeric molecules that target proteins to the Skp1-Cullin-F box complex for ubiquitination and degradation”, Sakamoto et al., PNAS, 2011, 98(15), 8554.
[6] “Targeted protein degradation by PROTACs”, T. K. Neklesa, J. D. Winkler, C. M. Crews, Pharmacology & Therapeutics, 2017, 174, 138.
[7] 고대경(2020), 차세대 표적항암제 플랫폼:프로탁(PROTACs), Weekly KDB Report, 6-9.
[8] 윤태진. (2017, April 12). 질병단백질 ‘죽음의 입맞춤’ 이끄는 연결 소분자. Available: http://scienceon.hani.co.kr/507517
그림1: https://www.abcam.com/index.html?pageconfig=resource&rid=13555
그림2: https://www.nature.com/articles/3780498
그림3: http://www.nifds.go.kr/brd/m_480/down.do?brd_id=3&seq=12146&data_tp=A&file_seq=1
Cover Image: https://cen.acs.org/articles/96/i8/targeted-protein-degraders-are-redefining-how-small-molecules-look-and-act.html
