[유전공학의 미래 #2] 보이지 않는 몸속 지휘자 : miRNA
한국인이 노벨상을 받을 수 있을까? 이 문제는 언제나 우리나라 과학계를 접하는 대중들의 화두였고, 항상 결론은 그럴 수 없다였다. 대한민국의 부실한 기초과학 지원으로 인한 과학계의 인력, 장비 부족과 늦은 출발로 인해 과학 선진국들보다 떨어지는 기술력으로 인하여 항상 불가능하다고 생각해왔다. 심지어는 전국민의 응원 속 과학계에 큰 족적을 남겼던 것만 같았던 황우석 박사마저 학계와 국민을 상대로 사기를 친 것으로 드러나면서 그러한 기대는 이제 한낱 망상만으로 여겨질 뿐이다. 하지만 이러한 상황 속에서도 기초과학의 새로운 지평을 개척하는 사람들이 있다. 이들은 척박한 현실 속에서도 꾸준히 세계 학계에 이름이 오르내리며, 노벨상 후보에 꼽히고 있다. 이 중 대표적인 인물이 김빛내리 서울대학교 생명과학부 석좌교수이다.

김빛내리 교수는 분자생물학계의 거장으로, 젊은 나이에도 불구하고 벌써 많은 업적을 남겼다. 대중들이 그녀의 이름을 들어봤을법한 곳은, 그녀의 COVID-19의 RNA 염기서열과 치료제에 관한 연구일 것이다. 그러나 그녀의 대표적인 업적은 miRNA의 역할에 대한 규명이다. miRNA는 생물학도라면 한 번 쯤 들어봤을 물질로, 우리가 흔히 접하는 생명과학 II에서도 잠시 다루어진다. 그러나 교과서에서는 miRNA가 세포의 번역전 유전자 발현 조절에 이용이 된다고만 서술되어있고, 자세한 역할에 대해서는 일체의 설명이 없다.
miRNA, siRNA, 그리고 미세 RNA의 활용 방안
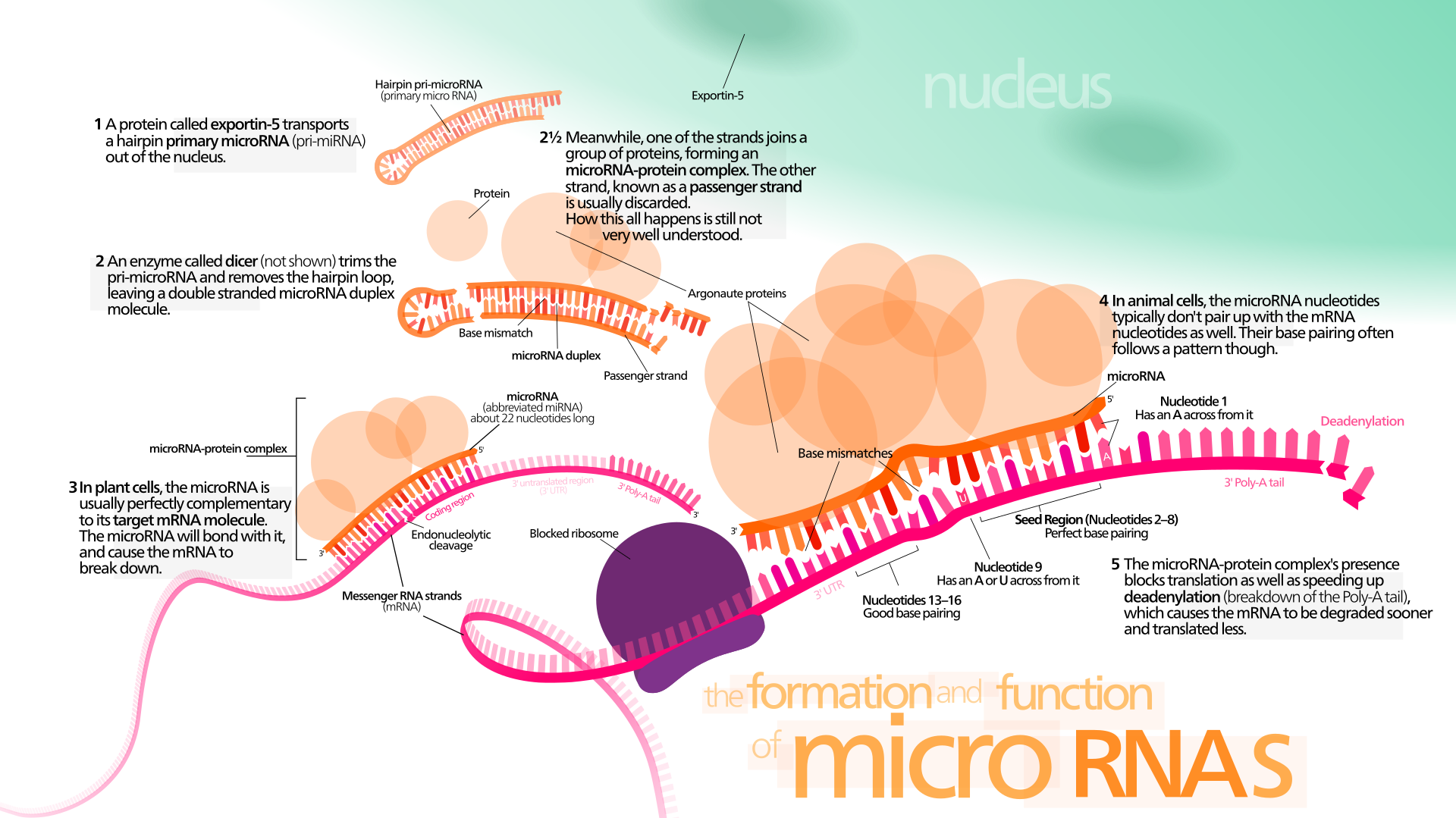
그렇다면 miRNA의 정확한 역할은 무엇일까? miRNA는 Micro RNA의 약자로, 이름에서 드러나듯이 짧은 염기서열이다. 22개의 염기서열로 이루어져 있어, 보통 수천에서 수만개의 염기서열로 이루어진 mRNA에 비해서 굉장히 짧다. miRNA는 앞서 말했듯이 유전자의 발현에서 번역전의 mRNA를 조절하는데 이용이 되는데, 보통의 유전자 조절이 그렇듯이 target mRNA를 상대로 하여 염기의 상보적인 결합을 통해서 조절이 된다. 먼저 전체적인 조절이 진행되기 전에 miRNA는 pri-miRNA의 상태로 존재하는데, pri-miRNA는 DNA 중 직접적으로 단백질의 정보를 담고 있지는 않은 인트론이 RNA로 전사가 되어 나타난다. 이때 pri-miRNA는 <그림 1>에서처럼 하나의 RNA 가닥으로 이루어진 miRNA와는 다르게 헤어핀 구조가 나타나 외부로 노출된 염기로 인해 변화하기 쉬운 miRNA의 염기 서열을 보호한다. pri-miRNA는 이후 Dicer Endonuclease/Helicase라고 하는 효소에 의해서 헤어핀 구조와 염기의 상보적인 결합이 나타나지 않은 pri-miRNA의 끄트머리 부근을 제거하고, miRNA를 두 개의 상보적인 결합이 나타난 단일 결합 염기 서열로 분리한다. 분리된 miRNA의 가닥 중 한 가닥은 Exportin-5 단백질과 결합하여 유전자 발현을 조절하는 miRNA 본연의 역할을 수행하지만, 나머지 한 가닥은 passenger strand가 되어 별다른 역할 없이 세포밖으로 배출이 된다. Exportin-5과 결합한 miRNA는 이제 번역의 과정에 돌입한 mRNA에서 상보적인 결합을 하는 염기서열을 찾아서 결합하고, 이때의 mRNA의 입체 구조의 변화로 인하여 리보솜이 mRNA에 정상적으로 결합하여 리보솜-mRNA 번역 복합체가 생성되지 못하고, mRNA가 생성될 때 RNA 스플라이싱의 과정과 동시에 진행이 되는 3'말단에 씌워져 mRNA를 보호하는 Polyadenine Cap이 디아데닐화의 과정을 거쳐서 점점 벗겨져 세포 내의 정상 기전으로 벗겨야 할 Adenine의 개수가 줄어들어 mRNA가 정상적으로 번역될 수 없어 mRNA에 대응되는 단백질의 생성량이 감소한다. 결론적으로 miRNA가 mRNA의 번역을 막고, 수명을 단축시켜 발현을 조절하며, 마치 보이지는 않지만 세포 작용의 지휘자와 같은 역할을 수행한다.
miRNA와 비슷한 역할을 하는 siRNA(Small Interfering RNA) 역시 같은 과정으로 mRNA의 번역을 조절한다. 하지만 siRNA와 miRNA는 역할과 작용범위에 차이가 있어 구분이 된다. siRNA의 경우, miRNA와 비교했을때 더 좁은 작용범위를 보여준다. 이는 siRNA의 경우, 가지고 있는 22개의 염기 서열이 모두 mRNA의 특정 부위와 상보적인 결합을 나타내지만, miRNA의 경우에는 2 ~ 8번째와 13 ~ 16번째의 염기 서열만 매칭이 되면 결합을 하기 때문에 결합이 이루어지는 경우가 siRNA와 비교했을 때 더 많은 mRNA 서열과 결합을 할 수 있다. 다만 식물세포의 경우에는 miRNA 역시 22개 염기 서열 모두 mRNA와 완벽한 결합을 하기에 miRNA와 siRNA를 식물에서는 구분하지 않는다. [1]
이렇듯 miRNA와 siRNA 모두 유전자의 발현을 조절하고, 또 연구가 이루어진지 얼마 안 된 분야이기에 과학자들의 관심이 집중되고 있다. mRNA의 발현을 조절하고, 짧아서 다루기도 쉽기에 여러 단백질의 생성으로 질환의 원인이 되는 퇴행성 뇌질환이나 암 등의 질환에서 직접 세포 내부로 투입되어 작용하는 기술에 대한 연구가 진행이 되고 있다. 미래 사회의 안전하고 더 나은 기술을 위해서라도 이러한 유전공학 기술에 대한 관심이 필요하다.
[1] J. K. Lam, M. Y. Chow, Yu Zhang, S. W. Leung, "siRNA Versus miRNA as a Therapeutic for Gene Silencing", Molecular Therapy Nucleic Acids, vol 4. pp. 252, Jan, 2015.
그림 1: https://www.youtube.com/watch?v=HcxEWMg7Xl0
그림 2: https://en.wikipedia.org/wiki/MicroRNA#/media/File:MiRNA.svg
