[유전공학의 미래 #1] Base Editing : 더 나은 유전자 편집을 위하여
오늘날 유전공학은 인류 역사상 그 어느 순간보다도 그 위상이 높으며, 가장 빠르게 발전하는 분야 중 하나이다. 100년전까지만 해도 유전의 원리와 그것이 이루어지는 물질을 발견하지 못했던 인류는 오늘날 모든 생명체의 생명의 암호를 분석하고, 그것을 인류의 생존에 알맞게, 또 빠른 시간 안으로 변형시킬 수 있는 능력을 가지게 됐다. 2000년전에 몇 십, 몇 백년, 아니 몇 천년 동안 걸쳐서 서서히 교배를 통해서 변형시킨 생물의 유전형질을 오늘날에는 실험실에서 며칠에 걸친 연구라면 완료할 수 있게 됐다. 유전자 편집의 정확성과 가성비도 초창기에 비해서 괄목할 수준으로 발전했는데, 초창기에 X선이나 감마선 등 고에너지파를 생물체에 쏴 쓸만한 유전형질이 나올 때까지 반복하던, 그저 운에 맡긴 과거와 달리, 오늘날에는 확실하게 유전체를 분석하고 정밀한 수선으로 원하는 부분만을 편집한다. 비용도 1세대 유전자 가위인 ZFC(Zinc-Finger Nuclease)나 2세대 유전자 가위인 TALENs(Transfer Activator-Like Nuclease)와 비교했을 때, 오늘날 널리 통용되는 3세대 유전자 가위인 CRISPR-Cas System는 인위적으로 합성한 단백질을 사용한 것이 아니라, 생물에 실제로 존재하는 단백질을 이용해 합성하는데 드는 비용을 획기적으로 줄였으며, 환경에 대한 민감성이 인위적이지 않다보니 줄어들어 과거보다 넓은 환경 조건에서 유전자 편집을 할 수 있다. 그야말로 과학 기술의 승리이다.
CRISPR-Cas System : 유전자 편집 기술의 대중화
이런 유전자 편집 기술 중 가장 널리 알려진 것이 아까 잠시 언급한 CRISPR-Cas System(통칭 CRISPR)일 것이다. 3세대 유전자 가위인 CRISPR는 매체에서의 등장과 스포트라이트로 대중들이 가장 많이 들어본 유전자 가위 중 하나인데, 오늘날 유전자 편집 기술의 집약체라고도 불린다. CRISPR는 Clustered Regularly Interspaced short Palindromic Repeats의 준말로, 다른 유전자 편집 기술들과는 다르게, 그 명칭에서 핵산을 자르는 핵산 분해 효소를 뜻하는 "Nuclease"를 찾아볼 수 없다. 이는 CRISPR가 단백질에 중점을 둔 것이 아니라, 다른 물질에 기초하여 유전자 편집을 함을 유추해낼 수 있는 자료이다. CRISPR의 약자는 다름 아닌 생물의 핵산의 특정 부위에 대한 설명으로, CRISPR가 인위적으로 단백질을 합성하여 만든 것이 아닌 생물 내에서 원래부터 유전자 편집을 진행하던 툴을 기반으로 함을 보여준다.
CRISPR는 생물의 유전체 내에서 특정 간격을 두고 회문 구조가 반복적으로 나타나는 부위를 일컫는 말로, 원래는 E.coli 등의 세균이 박테리오파지에 대항하는 면역 수단이었다. 박테리오파지가 세균 내에 침투하면 세균을 자신의 파지 생산 공장으로 만들기 위하여 viral DNA/RNA를 주입하는데, 이로 인해 많은 세균은 자신의 본연의 기능을 잃고 파지를 생산하게 되며, 이후에 사망하게 된다. 그러나 이 공격을 버틴 일부 세균들은 같은 박테리오파지의 공격에 대비하기 위해서 박테리오파지의 유전물질을 세균의 플라스미드 내에 저장하게 되는데, 이것이 CRISPR의 회문 구조 사이에 존재하는 Spacer DNA이다. 같은 박테리오파지의 공격이 또 다시 일어나면, 세균은 박테리오파지의 유전체를 Spacer DNA를 전사시킨 Spacer RNA와 대조하여 같은 염기서열이 발견이 되면 Cas(CRISPR associated protein) 중에서 Nuclease 기능을 수행할 수 있는 단백질을 이용하여 절단시켜 박테리오파지의 유전체의 기능을 무력화시킨다.
이것을 이용하여 인위적으로 특정 염기서열에 대해서 유전자 편집을 진행할 수 있는데, 염기서열을 자르는 Cas와 자르고 싶은 염기서열인 trRNA, 그리고 trRNA와 Cas가 결합하여 안정적인 CRISPR 복합체가 형성되도록 하는 crRNA를 이용하면 된다. 물론, 실제 실험에서는 번잡함을 줄이기 위해서 trRNA와 crRNA를 하나의 RNA로 이어붙인 키메라인 gRNA를 이용하며, 세포에 바이러스 벡터나 플라스미드 벡터 등 모종의 방법으로 gRNA와 Cas를 인코딩하는 유전체를 전달하면, 세포 내에서 알아서 전사 및 번역이 일어나며, 이들이 살아있는 세포 내의 유전자를 세균이 박테리오파지의 유전자를 무력화시키는 것과 같은 원리로 자를 수 있다.
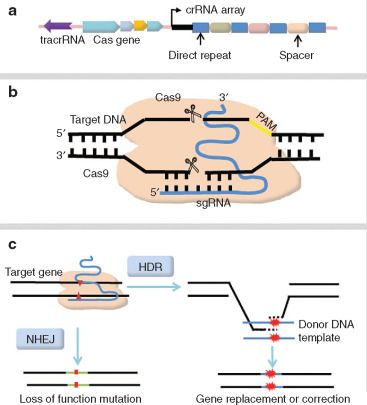
CRISPR가 세간의 주목을 받는 것은 이렇게 생물의 면역 체계를 가져와 이용하였기에 인위적으로 단백질을 합성한 과거의 사례와 달리, 시스템이 전체적으로 안정적이기 때문에 들어가는 비용이 훨씬 더 적고, 환경 조절을 덜 해도 돼서 실험을 하는 시간이 줄었다는 것에 있다. 실제로 CRISPR는 대학 학부 수준의 연구실에서 직접 실험할 수 있으며, 비용도 적게는 수십만원밖에 들지 않는다. 이러한 공로를 인정받아 2020년 CRISPR를 개발한 제니퍼 다우드나와 에마뉘엘 샤르팡티에의 연구진은 노벨 화학상을 수상했으며, 오늘날 전세계의 유전자 편집은 거의 CRISPR를 이용해서 이루어지고 있다고 보아도 과언이 아니겠다.
그럼에도 CRISPR에는 여전히 한계가 있다. CRISPR을 이용해서 염기서열의 특정 부분을 제거하면, 세포가 스스로 유전체를 복구하는데, 여기에는 2가지 경로가 있다. 첫번째 경로는 상동재조합(HR - Homologous Repair)로, 하나의 유전자가 일부 손상되면 상동염색체에서 같은 유전자를 복제해 다시 유전자를 복구하는 것이다. 이 경로는 변이가 생길 일은 없지만, 상대적으로 후자에 비해서 비효율적이어서 세포 내에서 잘 이용되지 않는다. 두번째 경로는 비상동재조합(NHEJ - Non-homologous End Joining)으로, 절단된 유전자의 남는 부분을 그냥 세포가 알아서 이어붙이는 것이다. 유전자의 5'과 3'을 아무 생각없이 바로 이어붙일 수도 있고, 아니면 새롭게 중합효소를 이용하여 새로운 염기서열을 추가할 수 있다. 이 방법은 더 효율적이지만 많은 문제가 발생할 여지를 남겨두고 있는데, 유전자 편집을 통해서 없어진 유전자의 이상 서열이 그대로 나타날 수도 있고, 아니면 또 다른 이상 서열이 합성되어 생명체에 악영향을 줄 수도 있다. 이와 같은 이유로, 단순히 유전자를 비활성화시키는 것이 아니라, 정상적인 염기서열을 형성하는데에는 아직까지 CRISPR가 크게 영향력을 발휘하고 있지 못하고 있다. 실제로 CRISPR를 이용해서 유전자 편집을 진행하면 NHEJ가 자주 발생하여 정확도가 그리 높지는 않으며, 새롭게 유전자를 집어넣겠답시고 따로 RNA를 준비하여 HR의 과정을 인터셉트하려고 해도 정확도가 10%에 불과하다. 따라서 더욱 향상된 정확성을 가진 유전자 편집 기술의 필요성이 대두되고 있다. [1]
Prime Editing : 새로운 지평을 열다

Base Editing은 이와 같은 CRISPR의 단점을 보완한 새로운 4세대 유전자 편집 기술이다. 인간에게서 발생하는 유전 질환의 거의 절반에 가까운 46%는 단순히 하나의 염기쌍이 바뀌어서 발생한 '점 돌연변이'이다. 예를 들면, 낫모양 적혈구 빈혈증의 환자는 적혈구의 모양이 낫모양으로 바뀌어 산소 운반을 하는데 어려움을 겪는데, 이는 4차 단백질인 헤모글로빈을 이루는 3차 단백질 중 하나인 베타글로빈 사슬을 인코딩하는 염색체의 17번째 염기가 정상인에서는 아데닌이어야 할 것이 티민이 되어 베타글로빈 폴리펩타이드 사슬의 6번째 염기가 글루탐산에서 발린이 됨에 따라서 입체적인 구조가 변화하여 나타난다. 이는 즉슨, 단순한 '점 돌연변이'만을 고칠 수 있는 기술을 개발한다면, 인류의 절반에 해당하는 유전질환을 치료할 수 있는 힘을 가지게 되는 것이다. 이것이 바로 Base editing이다. CRISPR의 염기 서열 인식 시스템은 그대로 가져와서 인식을 하는 높은 정확도는 유지하되, Cas의 2개의 Nuclease를 단일 염기를 변화시키는 단백질로 대체하여 직접 하나의 염기를 다른 염기로 바꾼다. Base Editing의 선구자인 데이비드 류 교수의 연구진은 이와 같이 Base Editing을 이용하여 CRISPR보다 훨씬 더 정확성이 높은 유전자 편집 기술을 개발했다고 한다. 물론, 염기를 변환시킬 새로운 단백질을 실험실 내에서의 자연선택 등으로 구하는 등 과정은 순탄치만은 않았지만, 또 Base Editing이 한계가 없는 절대적인 기술은 아니지만, Base Editing은 훨씬 더 양질의 유전자 편집을 우리에게 제공할 수 있을 것으로 보인다. 아직 초창기 단계에 있는 인간에 대한 유전자 편집도 더 나은 기술이 생기고, 지속적으로 진보하면 새로운 길이 열릴 것으로 생각된다. 더 나은 미래를 위하여.
[1] S. Yang, "Evaluating the accuracy of non-homologous end joining induced by a CRISPR-Cas9 system," M.S. thesis, Hanyang Univ, Seoul, 2017.
그림1: https://www.cell.com/molecular-therapy-family/nucleic-acids/fulltext/S2162-2531(17)30058-6
그림2: https://www.ted.com/talks/david_r_liu_can_we_cure_genetic_diseases_by_rewriting_dna
Cover Image: https://www.taconic.com/taconic-insights/model-generation-solutions/crispr-therapeutics-in-vivo.html
