퇴행성 신경질환: 유전적 요인
퇴행성 신경질환은 다른 퇴행성 질환과 마찬가지로, 나이가 들어감에 따라서 발병확률이 높아지는 질환으로, 이 중 특히 뇌와 신경계에 영향을 주는 질환을 일컫는다. 퇴행성 신경질환이 발병하면 특정 뇌세포군이 기능을 잃거나, 시냅스 사이의 정보전달을 매개하는 화학물질들의 분비와 흡수에 문제가 발생한다. 이는 궁극적으로 뇌세포의 사멸과 뇌의 전기적인 활동성을 낮추어 정상인의 뇌와 비교하였을 때 특정 부위의 반응 속도나 능력이 현저히 뒤떨어지게 만든다. 증상은 크게 세 분류로 나눌 수 있는데, 뇌 자체의 기능을 약화시키는 질환, 근육에 대한 뇌의 수의적 통제력을 약화시키는 질환, 근육의 불수의적 자율신경계를 약화시키는 질환이 있다. 고령화가 빠른 속도로 진행되면서 이러한 질환들은 우리 사회의 일상속으로 스며들고 있는데, 대표적인 질환으로는 알츠하이머 병, 파킨슨 병, 루게릭 병, 헌팅턴 무도증이 존재한다. [1]
단백질 응집증
퇴행성 신경질환의 원인으로 최근 단백질의 응집이 지목 받고 있다. 다수의 퇴행성 신경질환에서 공통적으로 단백질의 응집 및 침착이 발견이 되는데, 이것이 세포의 기능을 약화시킨다는 것이다. 단백질의 응집과 축적은 세포 내외부에서 모두 일어나며, 이로 인해 항산화 작용이 이루어지지 않아 산화적 스트레스가 누적되고, 단백질을 분해하는 프로테아좀에 저해제로 작용하며, 미토콘드리아가 ATP를 생산하지 못하게 해 결국 세포의 사멸에 이르게 한다는 견해이다. 이러한 단백질의 응집은 단백질의 입체 구조의 변화의 단백질 접힘으로 인하여 점차 세포 주위에 시간이 지날수록 응집 현상이 심화되며, 이것이 나이에 따른 발병률의 변화를 일으키는 주 원인이라는 것이 과학계의 정설이다.
주요 질환들을 예시로 들어보면, 알츠하이머에서는 베타-아밀로이드가 뭉처진 아밀로이드반(Amyloid Plaque), 타우 단백질이 PHF, SF 등의 필라멘트로 변성돼 축적된 신경섬유 응집체(NFT)가, 파킨슨 병에서는 루이 소체가 내부의 알파-시누클레인의 변성으로 인해 과도하게 누적되면서, 헌팅턴 무도증에서는 14번 염색체의 반복되는 CAG가 인코딩하는 폴리-글루타민 펩타이드의 길이에 따라서 아미노산 서열의 입체 구조가 변화하여 발생한다. 물론 퇴행성 신경질환은 유전적인 요인보다는 환경적인 요인이 더 큰 영향을 준다고 평가받고 있지만, 그렇다고 유전적인 요인을 무시할 정도는 아니다. 중심 원리에 따라 폴리펩타이드 사슬을 만드는 유전체의 변화나 차이로부터 퇴행성 뇌질환이 발생할 가능성이 있다. 알츠하이머를 중심으로 알아보자.
β-Amyloid 가설
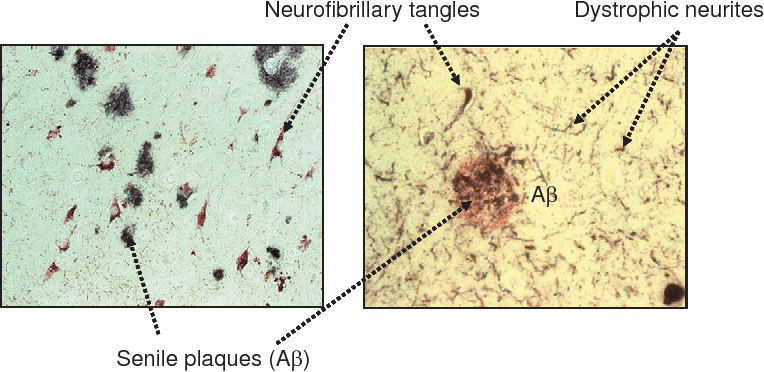
베타-아밀로이드(Aβ)는 알츠하이머의 발병에서 신경세포체 외부에서 아밀로이드반을 형성해 아세틸콜린의 화학 신호 전달을 방해하고, 신경세포체의 미토콘드리아의 호흡 작용에 영향을 미친다. 본래 베타-아밀로이드는 아밀로이드 전구단백질(APP)로부터 유래된 것으로, 아밀로이드 전구단백질이 베타와 감마 시크리테이즈에 의해서 편집된 것이다. 40~ 42 아미노산 정도의 폴리펩타이드 서열인 단일 베타-아밀로이드는 서로 수소 결합을 이루어 아밀로이드반을 형성한다. 이때 흥미로운 점은 아밀로이드 전구단백질이 베타-시크리테이즈가 아닌 알파-시크리테이즈로 절단될 때인데, 이때는 약 16 아미노산 길이의 p3을 만드는데, p3는 자매종인 베타-아밀로이드와는 다르게 신경세포체 내 영양인자로 작용한다. [2]-[3]
베타-아밀로이드 가설은 유전적으로 유효함이 알려져 있는데, 베타-아밀로이드를 만드는데 주요한 기능을 하는 베타-시크리테이즈 유전자가 21번 염색체에 위치하는데, 21번 염색체를 3개 가지고 있는 다운 증후군 환자들이 30대가 지나면 베타-시크리테이즈의 과다 발현으로 인해 알츠하이머 증세를 보인다는 것이 가장 큰 증거이다. 이외에도, 유전성 알츠하이머 환자의 대부분의 유전체에서 베타-시크리테이즈 유전자의 변이가 보이는 것 역시 증거이다. 베타-아밀로이드 가설에 영향을 주는 유전자는 크게 세 가지가 있는데, 먼저 앞서 소개한 베타-시크리테이즈 유전자, 11번 염색체에 위치한 아밀로이드 전구단백질 유전자, 그리고 14번 염색체의 프리세닐린 1/2(PS 1/2) 유전자이다. 아밀로이드 전구단백질 유전자의 변이는 전구단백질의 입체구조를 변형시켜 베타-아밀로이드의 생성에 영향을 줄 수 있다. 그리고 프리세닐린은 앞서 잠시 지나간 또 다른 시크리테이즈인 감마-시크리테이즈에 포함된 3차 단백질로, 프리세닐린의 변형은 감마-시크리테이즈의 인식 부위(PAM)에 영향을 주어 베타-아밀로이드의 생성 과정에 영향을 줄 수 있다.
이렇듯 베타-아밀로이드의 생성은 여러 유전인자의 영향을 받으며, 독성의 아밀로이드반을 형성해 시냅스를 파괴할뿐만 아니라 세포간의 신호전달 체계인 노치 신호전달(Notch Signalling)에도 영향을 준다.
Tau Protein 가설
타우 단백질은 알츠하이머의 발병에서 신경섬유 응집체(NFT)를 형성해서 신경세포 내부에서 세포의 활동을 방해한다. 타우 단백질은 원래 막단백질(MAP-MAPT)의 일종으로 세포막 사이에서 신호전달을 담당하고, 미세소관을 건설하는 역할을 한다. 그런데, 타우 단백질의 과인산화가 이루어지면, 타우 단백질은 다른 막단백질과의 상호작용을 멈추고 서로끼리만 반응하여 필라멘트를 형성하는데, 결합 부위에 따라서 나선형(PHF)와 직선형(SF)으로 나눌 수 있다. 둘 사이의 크게 차이는 없으며, 이들이 뭉쳐서 신경섬유 응집체를 형성해 세포의 신호전달을 방해한다. 이는 비단 알츠하이머에서뿐만 아니라, 타우 단백질은 Tauopathy로 알려진 신경질환의 집합의 원인으로 지목 받고 있다. 여기에는 파킨슨 등 유명 신경질환이 다수 있다. [4]
타우 단백질에 의해서 발생하는 신경질환이 이토록 많은 것은 전사 후 편집에 영향을 받기도 하는데, 타우 단백질은 단 하나의 단백질만을 일컫는 것이 아니라, 같은 DNA에서 전사되어 서로 다른 부분이 전사 후에 편집이 돼 발현한 6개의 단백질들의 집합체이다. 각각이 단백질의 크기와 입체구조에서 미세하게 다른 구조를 가지면서 많은 질환을 유도할 수 있었다. [5]
알츠하이머에서 타우 단백질은 과인산화된 것들끼리 필라멘트를 형성하거나, 과인산화된 것과 그렇지 않은 것이 뭉쳐서 중합체를 형성하기도 한다. 이 과정을 통해서 미세소관의 정상적인 타우 단백질을 분해하고, 세포 전체적으로 신호 전달을 악화시킨다. 이에 연관된 유전자는 17번 염색체 상에 존재하는 타우 단백질 유전자로, 과인산화가 이루어지는 빈도에 차이가 생겨 전체적인 알츠하이머의 진행 속도를 촉진시키기도 한다.
이처럼 유전적으로 크게 연관이 없을 것만 같은 질환도 알고 보면 유전적으로 무언가 세대 간의 연관성이 있다. 이외에도 자신의 관심사를 더 깊이 분석하고 찾아보면서 그 안에 내재된 과학적 원리와 자연의 질서를 찾아보도록 하자.
참고문헌
[1] 이정호, 김현진 and 백승렬, "단백질 응집: 퇴행성 신경질환과 아밀로이드," News & Information For Chemical Engineers, vol. 23, no. 1, pp 47 - 53, 2005.
[2] 장창환, 정민환 and 묵인희, "베타 아밀로이드 형성에 관여하는 효소와 그를 이용한 알츠하이머병 치료법 개발 동향," 한국뇌학회지, vol. 1, no. 1, pp 42-53, Jun. 2001.
[3] B. D. Strooper, R. Vassar and T. Golde, "The secretases: enzymes with therapeutic potential in Alzheimer disease," Nature Reviews Neurology, vol. 6, no, 2, pp 99-107, Jun. 2010.
[4] M. Kolarova, F. Garcia-Sierra, A. Bartos, J. Richy and D. Ripova, "Structure and Pathology of Tau Protein in Alzheimer Disease," International Journal of Alzheimer's Disease, vol. 2012, May. 2012.
[5] M. Goedert, "Tau Filaments in Neurodegenerative Diseases," FEBS Letters, vol. 592, pp 2383-2391, Jul. 2018
Cover Image: https://www.genengnews.com/news/no-cut-crispr-halts-progression-of-muscular-dystrophy-in-mice/
그림 1: https://www.semanticscholar.org/paper/Alzheimer's-disease-and-amyloid%3A-culprit-or-Skaper/669fa721c2a239f695ffad8b2f2a324b633aa16c
